
 |
|
Разделы
 Рекомендуем
|
Автоматическая электрика Автоматика радиоустройств мы - атома водорода. Расстояния между последовательными уровнями энергии закономерно уменьшаются, бесконечно сгущаясь у границы ионизации, соответствующей отрыву электрона. Энергия свободного, оторвавшегося от атома электрона может принимать непрерывные значения. Расстояние между самым нижним уровнем энергии и границей ионизации равно энергии ионизации. Самый нижний уровень соответствует состоянию атома с наименьшей энергией - его основному или нормальному состоянию, в котором атом, не подверженный внешним воздействиям, может находиться неограниченно долго. Все остальные состояния обладают большей энергией и представляют возбужденные состояния, имеющие конечное время жизни. Из такого возбужденного состояния атом может перейти в менее возбужденное или основное состояние, испустив фотон (излучательный переход). При наличии других частиц, с которыми атом сталкивается, энергия от атома может непосредственно перейти к частице без испускания фотона (безызлучательный переход). Энергетические состояния атома водорода характеризуются набором четырех квантовых чисел: п, I, mi и те. Главное квантовое число п, принимающее целые значения (я=1, 2, 3, ...), определяет возможные значения энергии стационарных состояний атома водорода и нумерует уровни в порядке возрастания энергии: п характеризует размеры электронных орбит. Азимутальное квантовое число / определяет возможные значения орбитального момента количества движения электрона в сферически симметричном поле и принимает любые пелые положительные значения включая нуль (1=0, 1, 2 ...). Состояния электрона со значениями 1=0, 1, 2, 3 ... обозначают как s, р, й, f (и т. д.) состояния. Магнитное квантовое число mi определяет величину проекции момента количества движения на произвольно выбранное направление. Когда внешнее магнитное поле, в котором находится атом, задает выделенное направление, то mi определяет величину проекции магнитного момента, пропорционального механическому моменту. Величина т( при заданном / принимает 21+1 значение, mt=l, I-1, -I. Спиновое квантовое число та принима-1 1 ет два значения: ms=~ и ms=-~ ~и определяет величину проекции спинового момента на выбранное направление. Важным свойством атома водорода (при пренебрежении спином электрона) является независимость его энергии от квантовых чисел / и rrii. Энергии состояний атома с данным значением п, но различными I и mi одинаковы - имеет место вырождение состояний атома. Уровень энергии называется невырожденным, если ему соответствует только одно состояние (один набор квантовых чисел), и вырожденным, если ему соответствует несколько состояний; число состояний с одинаковой энергией называется степенью или кратностью вырождения (при данном / имеется 21+1 состояний с различными mi; при заданном п 1=0, 1, п-1). Учет влияния спина на орбитальное движение электрона в атоме (спин - орбитальное взаимодействие) приводит к снятию вырождения. Наличие спин-орбитального взаимодействия приводит к малому расщеплению уровней энергии с к2, которое получило название тонкой структуры или мультиплетного расщепления. При этом состояния характеризуются уже полньш моментом количества движения j=l+s, получающимся путем сложения орбитального момента электрона /, определяемого квантовым числом I, и спинового момента электрона s, определяемого квантовым числом ms. Значения / определяются квантовым числом i=l±ms=l± . Наряду с тонкой структурой для атома водорода (так же как и для более сложных атомов) наблюдается сверхтонкая структура спектра, обусловленная взаимодействием электрона с механическим моментом ядра. Сверхтонкое расщепление примерно на три порядка меньше интервала между линиями тонкой структуры. Для атома водорода основной уровень благодаря взаимодействию полного электронного момента со спиновым моментом протона расщепляется на два близких подуровня, при переходе между которыми возникает излучение с длиной волны Я. 21 см., наблюдаемое для межзвездного водорода методами радиоастрономии. Для атомов с двумя или несколькими внешними электронами характеристика уровней энергии более сложна и может быть произведена, если исходить из характеристики отдельных электронов при помощи квантовых чисел nit /,-, s,-, и применять векторную схему сложения орбитальных моментов h и спиновых моментов Si. В случае так называемой нормальной связи, когда электростатическое взаимодействие электронов много больше их магнит- ных взаимодействий (именно это чаще всего и бывает), орбитальные моменты отдельных электронов U складываются в полный орбитальный момент атома L=Si, а спи- новые моменты - в полный спиновый момент s=Es;; затем сложение L и S дает полный момент атома J=L+S. Уровни энергии атома характеризуются значениями квантовых чисел L, S и J, определяющих величины соответствующих моментов. Квантовое число S при четном числе элект- ронов в атоме принимает целые значения (S=0, 1, 2, ...), а при нечетном числе - полуцелые значения IЛ = , ] Уровни энергии атомов принято обозначать символами %Lj, где значения Z,=0, . 1, 2, 3, 4, 5, 6, ... указывают прописными буквами S, Р, D, F, G, Н, I .. соответственно, величина x=2S+l определяет муль-типлетность уровней энергии атома. Так, Юг обозначает уровень с £=2, S=l (к- =2S+1=3) и /=2; So - уровень с £=0, S=0 (x=2S+l = l) и /=0. Иногда указывается электронная конфигурация атома, отражающая структуру его электронных оболочек. При этом выписывают подряд символы электронных со-, стояний, а вверху индексом указывают число электронов в этих состояниях. Так, у скандия Sc (порядковый номер Z=21) имеется два s-электрона с п=1, два s- и шесть р-электронов с п=2; два s-, шесть р- и один d-электронов с п=3 и два s-электрона с п=4. Это записывается так: ls22s22pe 3s23p63d4s2, причем конфигурацию одних только внешних электронов атома Sc можно записать в виде 3d4s2. Под действием внешнего однородного магнитного поля (явление Зеемана) или электрического поля (явление Штарка) происходит расщепление уровней энергии. Расщепление связано с наличием вырождения уровней свободного атома (в отсутствие поля энергия атома не зависит от квантового числа т), определяющего величину проекции вектора / и принимающего 27+1 значений. Между тем дополнительная энергия атома во внешнем поле зависит от т, что и обусловливает снятие вырождения и расщепление уровня с заданным J. Молекулярные спектры наблюдаются в виде более или менее широких полос, состоящих из совокупности тесно расположенных линий. Сложность полосатых молекулярных спектров по сравнению с линейными атомными определяется тем, что движение в молекулах более сложно, чем в атомах: наряду с движением электронов относительно ядер, составляющих молекулу атомов, происходит колебательное движение самих ядер около положений равновесия и вращательное движение молекулы как целого. Трем видам движения в молекуле - электронному, колебательному и вращатепь-ному - соответствуют три типа квантовых состояний и уровней энергии. Полная энергия молекулы с хорошей степенью приближения может быть представлена как сумма квантованных значений энергий электронного Езп, колебательного £КОл и вращательного £вр движений. Отношение величин Езп £кол £Вр- 1 са электрона, М - М масса (т - мас- ядер атомов, входящих в состав молекулы; -<М>-Ч-1*-);*.~ I *-(т=-£-* 104 слГ1 , £ 10-1-МО-2 эв -у = = 103 -г-102 ejK 1j ; £вр 10-3 ч-Ю-5 эв 10 -т- Ю-1 см~~1 j . Различные типы молекулярных спектров возникают при различных типах переходов между уровнями молекул. Частота перехода / может быть определена из уравнения hf = E -Е = (Е ЭЛ-Е;Л) + Г (кол кол) Т (вр вр) = = Д£эл + Д£Кол + Д£ВР; А£эл > # > Д£кол Д£вр. При АЕэпФО возникают электронные спектры, расположенные в -видимой и ультрафиолетовой областях. При этом обычно ДВнолО и АЕВрфО. Таким образом, электронные спектры точнее можно назвать электронно - колебательно - вращательными. При Д£8л=0 и ДЕкопО получаются колебательные спектры, наблюдаемые в близкой инфракрасной области. Обычно одновременно АЕерфО. При Д£зл=0 и ДЕнол;=0, а Д£вр=£0 получаются состоящие из отдельных линий чисто вращательные молекулярные спектры, наблюдаемые в далекой инфракрасной и микроволновой (СВЧ) областях. Для характеристики спектров необходимо знать вероятности переходов между уровнями или связанные с ними времена жизни атомов или молекул ik в соответствующих состояниях. Время жизни ть характеризует временной интервал, в течение которого населенность частиц уровня k убывает в е раз. Время жизни является величиной, обратной полной вероятности перехода из состояния k во все другие состояния в единицу времени (вероятность спонтанного излучения в единицу времени) TR=1/V7b. Конечное время жизни уровней ведет в силу соотношения неопределенностей для времени и энергии Д£Дс А к расширению спектральных линий Вызванная этим ширина линий называется естественной где Тк и Тг - Бремена жизни в k и i состояниях (уровнях) соответственно. Обычно под шириной спектральной линии, подразумевается расстояние между точками ее контура, соответствующими интенсивности, равной lk от максимальной ( полуширина линий). Ширина спектральных линий характеризует степень монохроматичности излучения квантовых систем. Уширение линий можно трактовать таким образом: собственные колеба- ния излучающей системы должны быть затухающими, так как при излучении система теряет энергию. Но затухающее колебание не является монохроматическим, а содержит целый набор частот. Таким образом, затухание, вызванное, излучением (радиационное затухание), приводит к сокращению времени жизни возбужденных состояний и уширению спектральных линий. Для интенсивных переходов в видимой области спектра время жизни т=10~8 сек. Продолжительность жизни уровней, переходы с которых запрещены правилами отбора, может быть на несколько порядков больше этой величины. Излучение света с метастабильных уровней в обычных источниках света не наблюдается, так как эти уровни разрушаются за счет столкновений раньше, чем за счет излучения. Для очень разреженных газов, в которых время между столкновениями превышает время жизни возбужденных частиц, может непосредственно наблюдаться испускание света мета-стабильными атомами (например, свечение кислорода и азота в верхних слоях атмосферы). В большинстве случаев ширины линий спектров во много раз превышают радиационные как из-за взаимодействия с окружающими частицами, так и из-за влияния эффекта Допплера. Допплеровское ушире-ние спектральных линий объясняется тем, что допплеровское смещение частоты излу-v чения f ~ различно для разных атомов (или молекул) вследствие различия их скоростей. 29-4. МОЛЕКУЛЯРНЫЕ И АТОМНЫЕ КВАНТОВЫЕ ГЕНЕРАТОРЫ СВЧ ДИАПАЗОНА Квантовый генератор на пучке молекул аммиака. Исторически первым квантовым прибором * явился молекулярный генератор на пучке молекул аммиака, в котором для создания неравновесного состояния использовалось разделение ( сортировка ) молекул, обладающих разными энергиями. В процессе сортировки из объема удаляются молекулы, находящиеся на нижнем энергетическом уровне, т. е. создается система, в которой большинство молекул обладает избытком энергии. В процессе работы системы молекулы, совершившие переход с верхнего уровня на нижний, удаляются из рабочего объема и используются снова для пополнения запаса молекул, находящихся на верхнем энергетическом уровне. * Согласно американской терминологии квантовые генераторы н усилители СВЧ диапазона называются мазерами . Название мазер происходит из первых букв английской фразы: micro-wave amplification by stimulated emission of radiation* - усиление микроволн (т. е. СВЧ колебаний) индуцированным испусканием излучения. Выбор аммиака в качестве первого рабочего вещества определялся тем, что его свойства были хорошо изучены радиоспектроскопическими методами. В системе энергетических уровней этого газа имеется переход, характеризующийся в равновесном состоянии сильным поглощением на волне 1,27 см (/-23 600 Мгц). До сих пор не нз- выход сигнала. 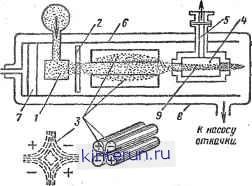 Рис. 29-7. Схема устройства квантового генератора на пучке молекул аммиака. I - источник пучка; 2 - диафрагма; 3 - квадру* польный конденсатор; 4 - резонатор; 5-волновод; 6 - охлаждаемый кожух; 7 - жидкий азот; 8-корпус; 9 - молекулярный пучок. вестны вещества, обладающие в сантиметровом диапазоне более интенсивными спектральными линиями, чем аммиак. Схема конструкции молекулярного генератора на аммиаке приведена иа рис. 29-7. Элементы генератора монтируются в сосуде, из которого откачивается воздух. Источник аммиака представляет собой резервуар, в котором поддерживается давление 5-20 мм рт. ст. Молекулы под влиянием разности давлений выходят из резервуара через небольшие отверстия (диаметр отверстия должен быть меньше длины свободного пробега молекул в газе). К выходящему молекулярному пучку предъявляются два требования. Первое состоит в том, что пучок должен быть достаточно интенсивен; второе - не допускать соударений молекул в пучке, так как такие соударения вызывают нежелательные переходы в молекулярной системе. Далее пучок молекул подается на сортирующее устройство - систему, образующую неоднородное электрическое поле. Принцип сортировки молекул по их энергетическим уровням основан на законах взаимодействия молекул, обладающих электрическим дипольным моментом, с неоднородным энергетическим полем. Неоднородное поле создается квадрупольным (четырехпо-люсным) конденсатором, состоящим из четырех стержней - электродов, имеющих сечение специальной формы и расположенных симметрично относительно оси пучка молекул и параллельно ей. Электроды попарно
|
|
© 2010 KinteRun.ru автоматическая электрика
Копирование материалов разрешено при наличии активной ссылки. |